Un gruppo di ricercatori sviluppa neuroni artificiali che riproducono per la prima volta ampiezza, energia e dinamiche dei neuroni biologici, aprendo la strada a un nuovo paradigma nella computazione neuromorfica e nelle interfacce bioelettroniche. Questi dispositivi utilizzano memristori derivati da proteine per generare picchi di tensione continui simili ai potenziali d’azione naturali, operando a voltaggi inferiori a 130 millivolt e con correnti nell’ordine dei nanoampere. Il consumo energetico, compreso tra 0,3 e 100 picojoule per picco, rientra perfettamente nel range biologico, rendendo questi neuroni i primi a garantire corrispondenza funzionale completa con la fisiologia neuronale. Integrando sensori chimici per ioni e neurotrasmettitori, i dispositivi non solo imitano l’attività neuronale ma anche la neuromodulazione biologica, con la capacità di collegarsi a cellule reali e processare segnali in tempo reale.
Il memristore bio-amplitudine come unità di base
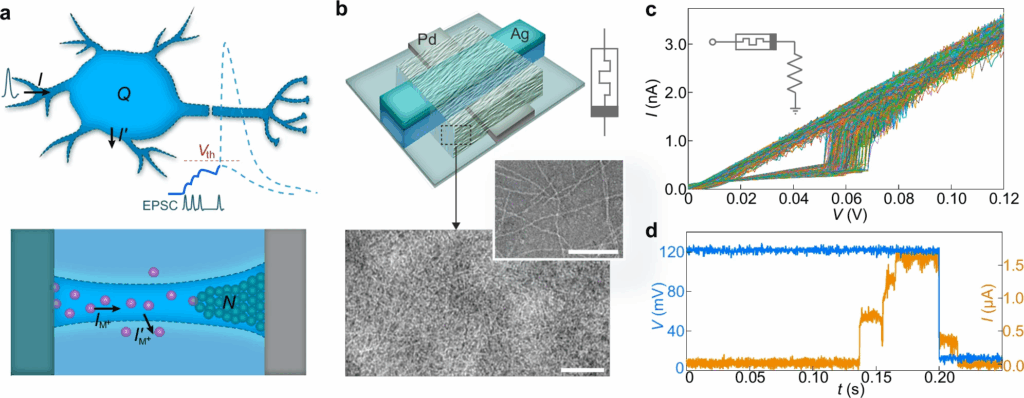
Il cuore del sistema è un memristore bio-amplitudine realizzato su wafer di silicio con ossido termico e elettrodi multistrato di cromo, palladio e argento. Lo spessore varia da 3 a 50 nanometri, mentre la larghezza misura 20 micrometri. Il componente chiave è rappresentato dai nanowire proteici di Geobacter sulfurreducens, con diametro di 2-3 nanometri, che formano una rete conduttiva densa e dinamica. Questi filamenti biologici agiscono come canali ionici artificiali, accumulando carica e rilasciandola in modo volatile, in un processo analogo alla depolarizzazione e ripolarizzazione neuronale.
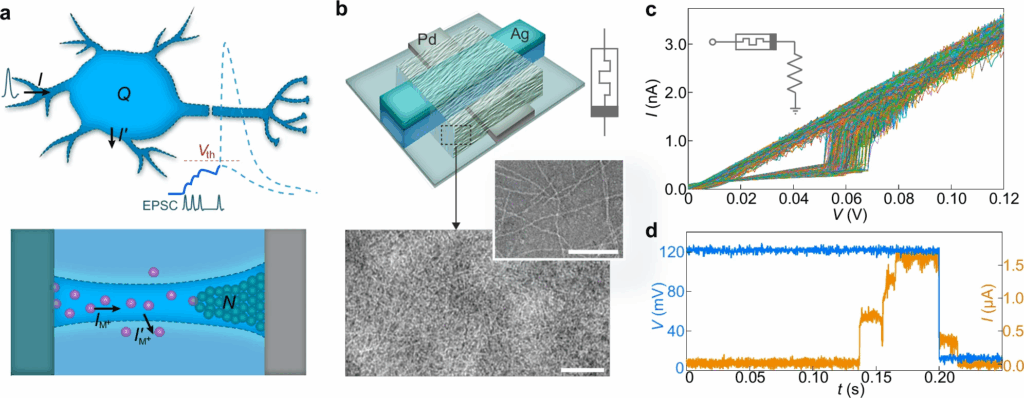
Il memristore mostra switching a 60 ± 3 millivolt e 1,7 ± 0,06 nanoampere, valori equivalenti ai parametri di membrana di un neurone vivo. La resistenza off raggiunge 200 megaohm, comparabile alla resistenza della membrana cellulare, mentre la volatilità intrinseca consente il ritorno spontaneo allo stato iniziale. Test multipli evidenziano integrazione del segnale in circa 0,13 secondi e ritorno off in 0,21 secondi, tempi coerenti con la temporalità dei potenziali d’azione biologici. Questa precisione nei parametri fisici e temporali rappresenta un traguardo tecnico cruciale, chiudendo il gap storico tra elettronica e biologia neuronale.
Neurone artificiale a bio-amplitudine
Per emulare il comportamento del neurone, i ricercatori integrano il memristore in un circuito RC composto da un condensatore da 33 nanofarad e un resistore da 1 megaohm. Applicando impulsi di 120 millivolt per 5 millisecondi con frequenze da 10 a 100 hertz, il sistema genera spike di tensione che seguono la sequenza naturale di integrazione, firing e refrattario.
Durante il ciclo, lo stato off del memristore accumula carica fino al passaggio on, caricando il condensatore a oltre 250 volt/secondo, equivalente all’influx di ioni sodio in un neurone biologico. Quando il condensatore si scarica attraverso il resistore, avviene la repolarizzazione, simulando l’efflusso di potassio e instaurando un periodo refrattario. I picchi risultanti raggiungono 120 millivolt di ampiezza con durata da 1 a 5 millisecondi, regolabile tramite costanti RC.
La risposta del sistema presenta stocasticità fisiologica, cioè piccole variazioni casuali in ampiezza e frequenza, che diminuiscono con l’aumento della frequenza di stimolo, proprio come nei neuroni reali. Le curve di risposta frequenza mostrano un aumento progressivo e saturazione oltre i 100 hertz, dovuto al bilancio tra leakage e refrattarietà. In configurazioni ottimizzate, l’energia di spiking scende fino a 0,2 picojoule, corrispondendo perfettamente ai valori energetici osservati nel cervello umano.
Neuromodulazione chimica con sensori integrati
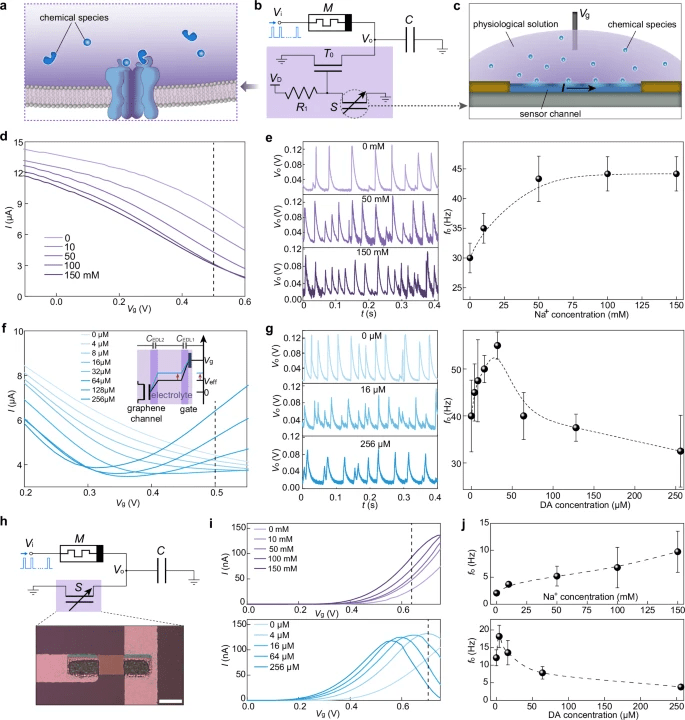
Per introdurre la modulazione chimica, i ricercatori sostituiscono il resistore con un transistor n-type il cui gate è controllato da un divisore di tensione composto da resistori e chemiresistori sensibili a ioni e neurotrasmettitori. Questa architettura permette di riprodurre la neuromodulazione biologica in modo dinamico e reversibile.
Un sensore PEDOT:PSS rileva variazioni di concentrazione di sodio da 0 a 150 millimolari, modificando la conduttanza da 0,2 a 1,3 megaohm. L’aumento di resistenza accelera la repolarizzazione e aumenta la frequenza di firing, saturando oltre 50 millimolari, in perfetta analogia con i meccanismi di eccitabilità neuronale. Parallelamente, un sensore al grafene rileva la dopamina in concentrazioni fino a 256 micromolari, generando una risposta ambipolare: l’aumento o la diminuzione di dopamina modula la frequenza di firing di ±30%, esattamente nel range fisiologico (20–39%). Il sistema mantiene consumi cento volte inferiori ai circuiti CMOS convenzionali e risulta pienamente compatibile con integrazione su chip. Queste caratteristiche aprono la via a reti neuromorfiche chimicamente sintonizzabili, capaci di adattarsi a stimoli ambientali o biologici in tempo reale.
Connessione diretta con cellule biologiche
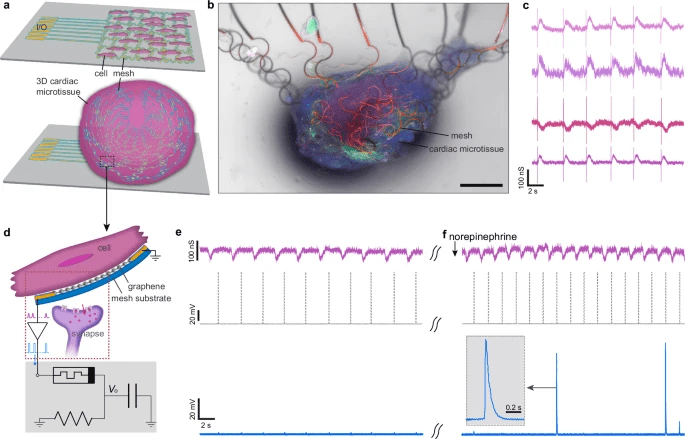
Per dimostrare l’integrazione bioelettronica, i ricercatori sviluppano una mesh tridimensionale flessibile in SU-8 da 0,5 µm, con sensori in grafene 20×20 µm² e interconnessioni in oro. Su questa matrice vengono coltivati cardiomiociti derivati da cellule staminali embrionali umane, che stabiliscono connessioni funzionali con i neuroni artificiali. I sensori rilevano potenziali d’azione e contrazioni con segnali distinti: picchi “sharp” per impulsi elettrici e “broad” per deformazioni meccaniche. Durante le registrazioni, condotte a 20 kHz e con bias di 5–10 millivolt, l’aggiunta di norepinefrina (10 µM) aumenta la frequenza dei battiti da 0,4 a 0,6 hertz, inducendo firing sincronizzato nei neuroni artificiali. Il sistema riconosce anche pattern aritmici simulati da dati clinici, mostrando capacità di diagnosi e risposta in tempo reale. Questa dimostrazione segna la prima prova di signaling cell-to-cell diretto tra cellule biologiche e neuroni artificiali, un passo fondamentale per future protesi neurali, sistemi di monitoraggio cardiaco e bio-interfacce terapeutiche.
Impatto sulla computazione neuromorfica e la bioelettronica
L’esperimento stabilisce un nuovo riferimento nella scienza dei dispositivi neuromorfici. I neuroni artificiali bio-emulati operano in range biologici di voltaggio, corrente e energia, introducendo modulabilità chimica e connessione diretta con tessuti viventi. Ciò permette la creazione di reti neuromorfiche ibride, in cui elementi artificiali e biologici condividono linguaggi comuni basati su segnali ionici e potenziali d’azione. Le implicazioni spaziano dal calcolo a basso consumo energetico alle interfacce cervello-macchina, fino a sensori diagnostici adattivi e biocomputazione medica. I memristori proteici forniscono plasticità sinaptica naturale, consentendo apprendimento locale e adattamento spontaneo senza circuiti esterni complessi. L’efficienza energetica e la scalabilità dei materiali bio-derivati rendono questa tecnologia sostenibile, riproducibile e compatibile con architetture CMOS, favorendo la transizione da elettronica ispirata alla biologia a una vera elettronica integrata con la biologia. Dal punto di vista fisico, il sistema sfrutta filamenti conduttivi dinamici che si formano e si dissolvono all’interno dello strato di ossido sotto tensione controllata, emulando i meccanismi di gating ionico neuronale. Le simulazioni mostrano che il consumo energetico per spike scende fino a 0,2 picojoule, mentre la densità di corrente rimane sotto i 2 nanoampere, equivalenti a quelli dei neuroni corticali umani. La frequenza massima di firing raggiunge 100 hertz, con ampiezze di picco e tempi di risposta sovrapponibili alla fisiologia cerebrale. Il sistema mantiene stabilità per oltre 1000 cicli di attivazione, garantendo ripetibilità e affidabilità sperimentale. Con questa ricerca, la frontiera tra biosistemi e elettronica diventa permeabile: la computazione neuromorfica non si limita più a imitare il cervello, ma inizia a dialogare con esso in tempo reale, condividendo la stessa lingua elettrica e chimica.
Iscriviti alla Newsletter
Non perdere le analisi settimanali: Entra nella Matrice Digitale.
Matrice Digitale partecipa al Programma Affiliazione Amazon EU. In qualità di Affiliato Amazon, ricevo un guadagno dagli acquisti idonei. Questo non influenza i prezzi per te.